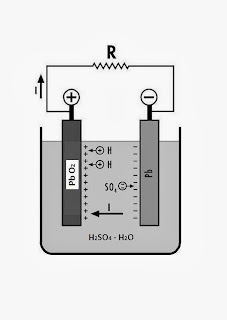
Fase di scarica
La batteria è inizialmente caricata chimicamente durante il processo di fabbricazione. Le piastre positive sono costituite da piombo ricoperto da biossido di piombo (PbO2), mentre quelle negative sono di piombo metallico poroso (Pb). Per via della diversa composizione chimica le due piastre costituiscono una coppia elettrolitica che genera una differenza di potenziale elettrico a contatto con la soluzione elettrolitica di acqua distillata (H2O) e acido solforico (H2SO4). La soluzione acida genera la reazione elettrochimica e assicura la conducibilità elettrica tra le piastre all’interno della cella.
Con la concentrazione standard di acido al 33%-38% la densità dell’elettrolito può variare da 1.250 gr/litro nei climi caldi a 1.300 gr/litro nei climi freddi.
Nella nostra zona temperata la densità dell’elettrolito si stabilizza intorno a 1.270 – 1.280 gr/litro. Collegando un utilizzatore R ai poli la differenza di potenziale tra gli elettrodi genera una corrente elettrica all’esterno e all’interno della cella, come si può vedere dalla figura. Il flusso di corrente esterno alla cella causa i tipici effetti della corrente elettrica: calore, luminosità, campo magnetico. Internamente la reazione elettrochimica tende a ristabilire l’equilibrio elettronico tra i due elettrodi carichi con polarità opposte, fino alla completa scarica della cella che si manifesta con la perdita di densità dell’elettrolito (1.120 gr/litro) e la solfatazione temporanea delle piastre.
Nella nostra zona temperata la densità dell’elettrolito si stabilizza intorno a 1.270 – 1.280 gr/litro. Collegando un utilizzatore R ai poli la differenza di potenziale tra gli elettrodi genera una corrente elettrica all’esterno e all’interno della cella, come si può vedere dalla figura. Il flusso di corrente esterno alla cella causa i tipici effetti della corrente elettrica: calore, luminosità, campo magnetico. Internamente la reazione elettrochimica tende a ristabilire l’equilibrio elettronico tra i due elettrodi carichi con polarità opposte, fino alla completa scarica della cella che si manifesta con la perdita di densità dell’elettrolito (1.120 gr/litro) e la solfatazione temporanea delle piastre.
Reazione anodica sull’elettrodo negativo
Pb + HSO₄¯ˉ → PbSO₄ + H⁺ + 2е¯
Reazione catodica sull’elettrodo positivo
PbO₂ + HSO4¯ + 3H⁺ + 2е¯ˉ → PbSO₄ + 2H₂O
Reazione complessiva di scarica
Pb + PbO₂ + 2H₂SO₄ → 2PbSO₄ + 2H₂O
Fase di carica
Collegando un generatore di corrente continua ai poli della cella il passaggio di elettroni si inverte causando lo spostamento forzato delle cariche elettriche negative dalle piastre positive a quelle negative con conseguente ripristino dei composti chimici iniziali e della differenza di potenziale elettrico. Questo avviene grazie alla reversibilità della reazione chimica nella cella piombo-acido: il solfato di piombo precedentemente depositato sulla superficie delle piastre si distacca e ritorna in soluzione riportando la densità della soluzione al valore iniziale di 1.270 – 1280 gr/litro.
NOTA
Il solfato di piombo è un cattivo conduttore della corrente. Depositandosi sulle piastre durante la fase di scarica ne aumenta la resistenza limitando, conseguentemente, il passaggio della corrente. A questo si aggiunge la perdita di conducibilità della soluzione elettrolitica dovuta alla diminuzione della densità per via dei composti sulfurei che si depositano sulle piastre durante la fase di scarica. Una cella carica ed efficiente presenta una resistenza interna molto bassa, mentre una cella scarica o invecchiata con solfatazione permanente presenta una elevata resistenza interna che ne riduce considerevolmente le prestazioni.
Reazione anodica sull’elettrodo negativo
PbSO4 + H⁺ + 2е¯ˉ → Pb + HSO₄¯
Reazione catodica sull’elettrodo positivo
PbSO₄ + 2H₂O → PbO₂ + HSO₄¯ˉ + 3H⁺ + 2е¯
PbSO₄ + 2H₂O → PbO₂ + HSO₄¯ˉ + 3H⁺ + 2е¯
Reazione complessiva di carica
2PbSO₄ + 2H₂O → Pb + PbO₂ + 2H₂SO₄
2PbSO₄ + 2H₂O → Pb + PbO₂ + 2H₂SO₄